临床微生物标本采样与送检
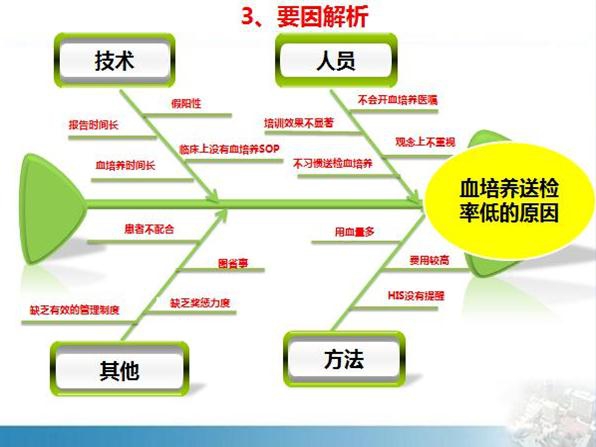
分享血培养送检率低的鱼骨图
默认分类 • dearhang 发表了文章 • 0 个评论 • 686 次浏览 • 2017-01-03 13:48
血培养及其它无菌体液是有价值的临床微生物样本,而目前国内的现状是送检最多的是呼吸道样本。如何提高血培养及其它无菌体液送检率?与各位同道分享我做的血培养送检率低的要因分析,请多提宝贵意见。
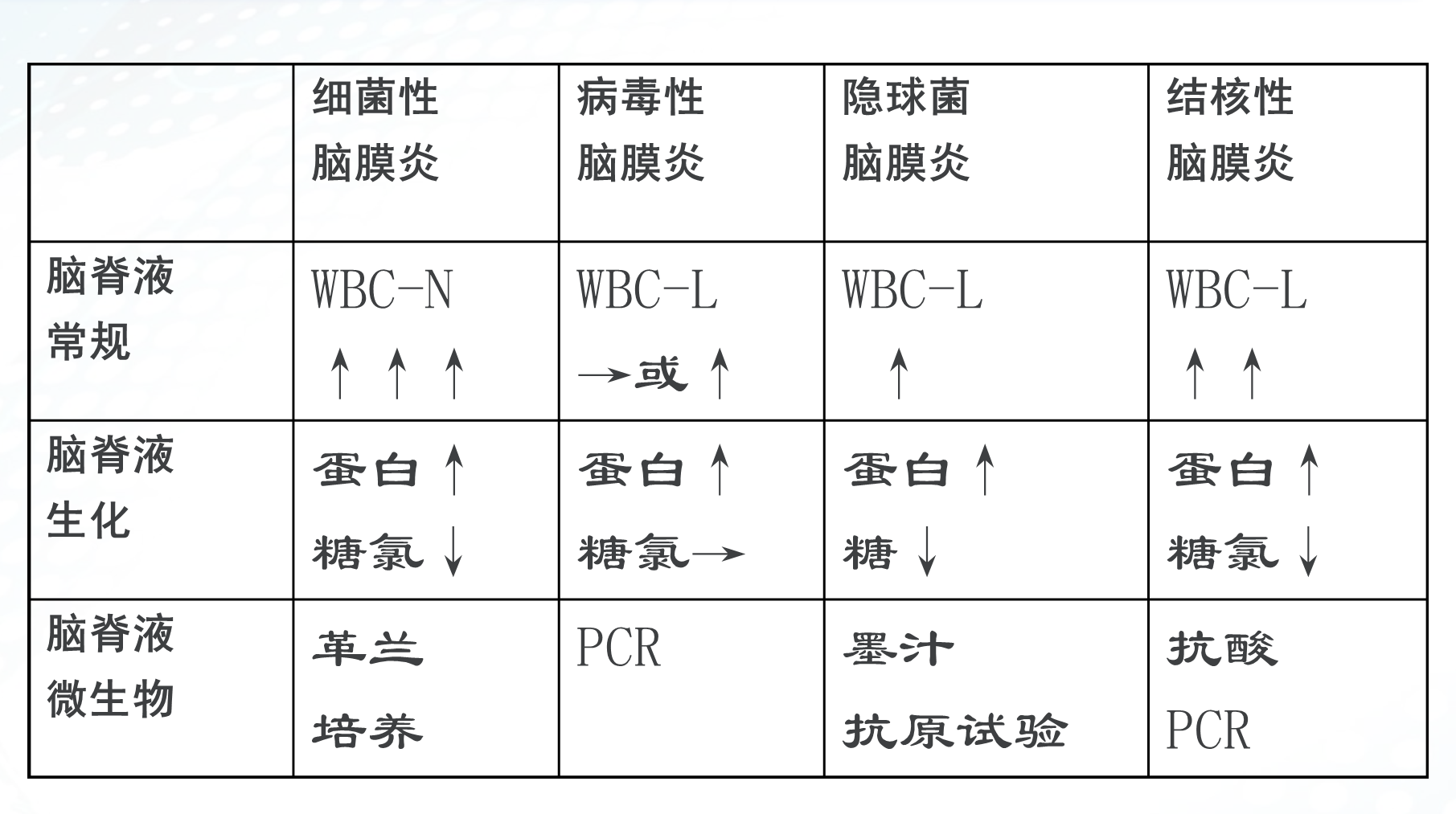
关注脑脊液常规、生化及培养的结果解读
默认分类 • dearhang 发表了文章 • 0 个评论 • 445 次浏览 • 2017-01-03 13:33
对于患者是否发生中枢神经系统感染,我们需要关注脑脊液的常规、生化及培养结果,结合患者临床症状体征进行判定,在此提醒脑脊液检查送检顺序:1-化学和免疫学 ,2-微生物, 3-理学和细胞学。
分享血培养送检率低的鱼骨图
默认分类 • dearhang 发表了文章 • 0 个评论 • 686 次浏览 • 2017-01-03 13:48
血培养及其它无菌体液是有价值的临床微生物样本,而目前国内的现状是送检最多的是呼吸道样本。如何提高血培养及其它无菌体液送检率?与各位同道分享我做的血培养送检率低的要因分析,请多提宝贵意见。
关注脑脊液常规、生化及培养的结果解读
默认分类 • dearhang 发表了文章 • 0 个评论 • 445 次浏览 • 2017-01-03 13:33
对于患者是否发生中枢神经系统感染,我们需要关注脑脊液的常规、生化及培养结果,结合患者临床症状体征进行判定,在此提醒脑脊液检查送检顺序:1-化学和免疫学 ,2-微生物, 3-理学和细胞学。
小实验:验证飞沫传播1米距离
默认分类 • dearhang 发表了文章 • 0 个评论 • 440 次浏览 • 2017-01-03 13:03
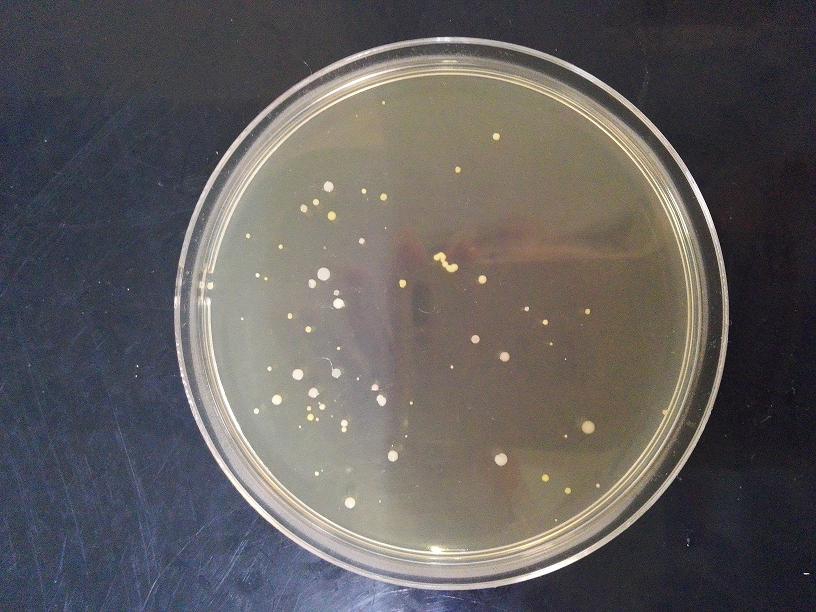
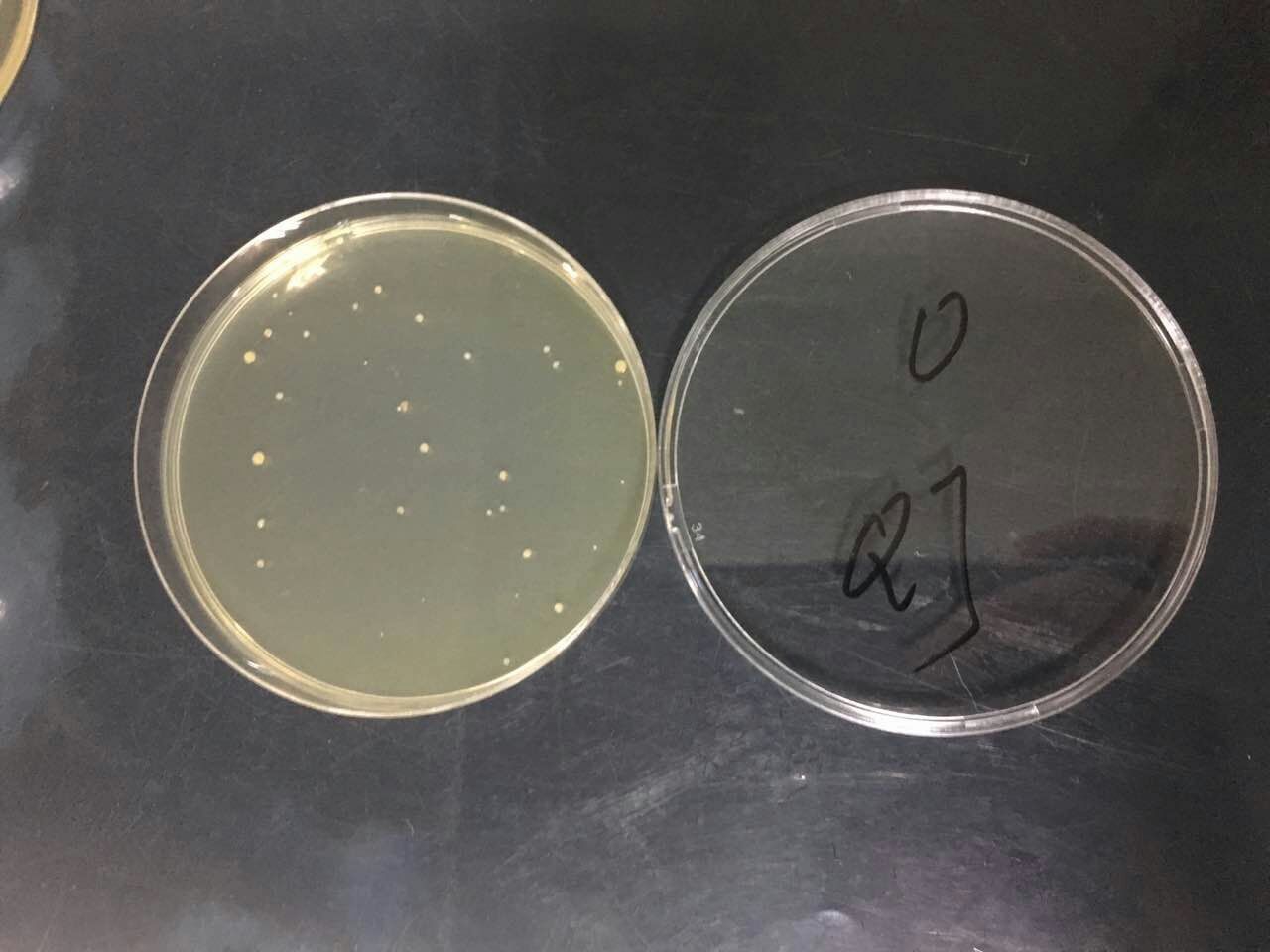
之前,我们监测使用中三类环境的空气,出现了这样的平皿:
我们很想知道这样的情况是如何产生的,首先我们考虑是因为说话,飞沫导致的。于是我们进行了一个小实验:
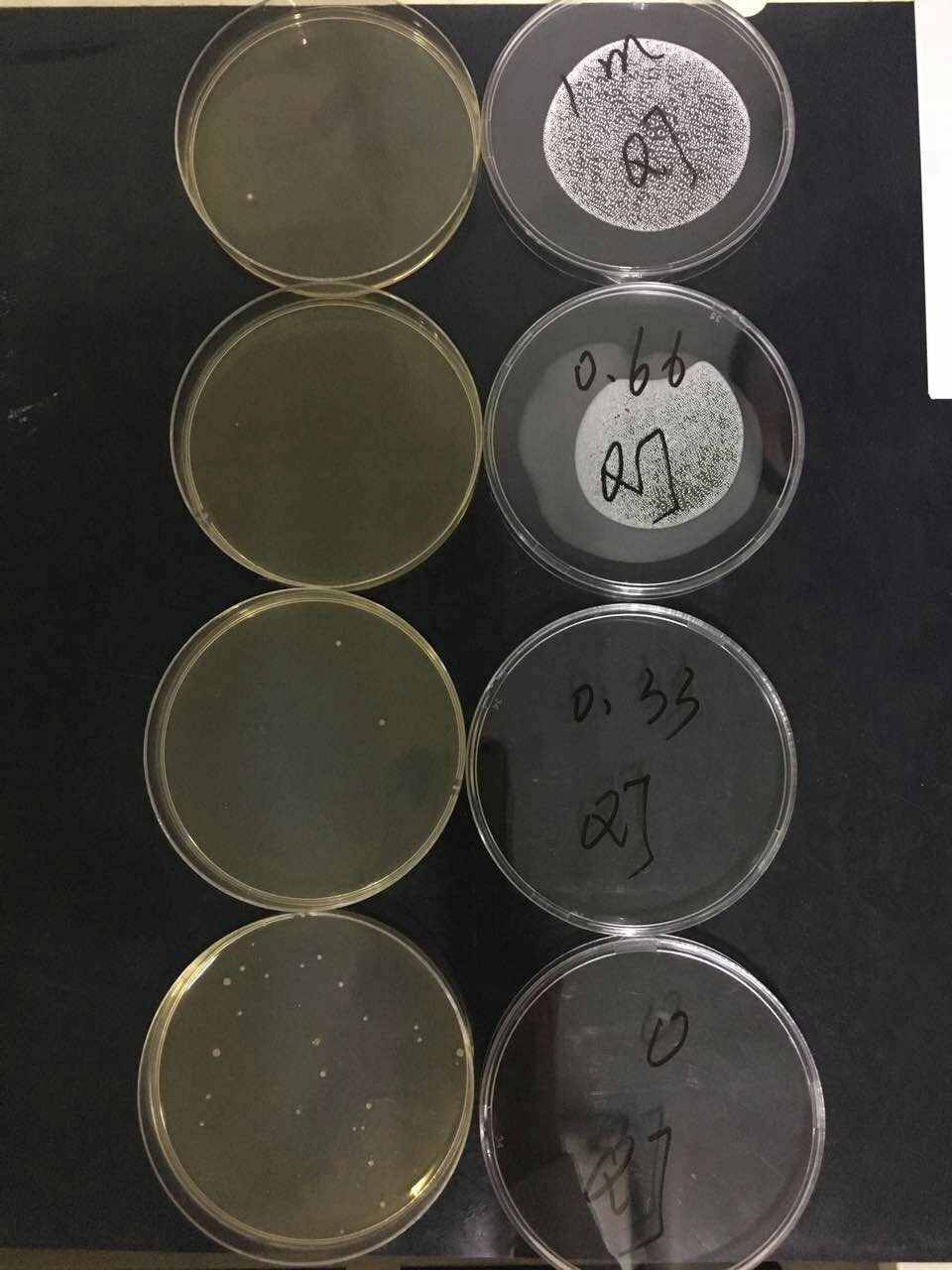
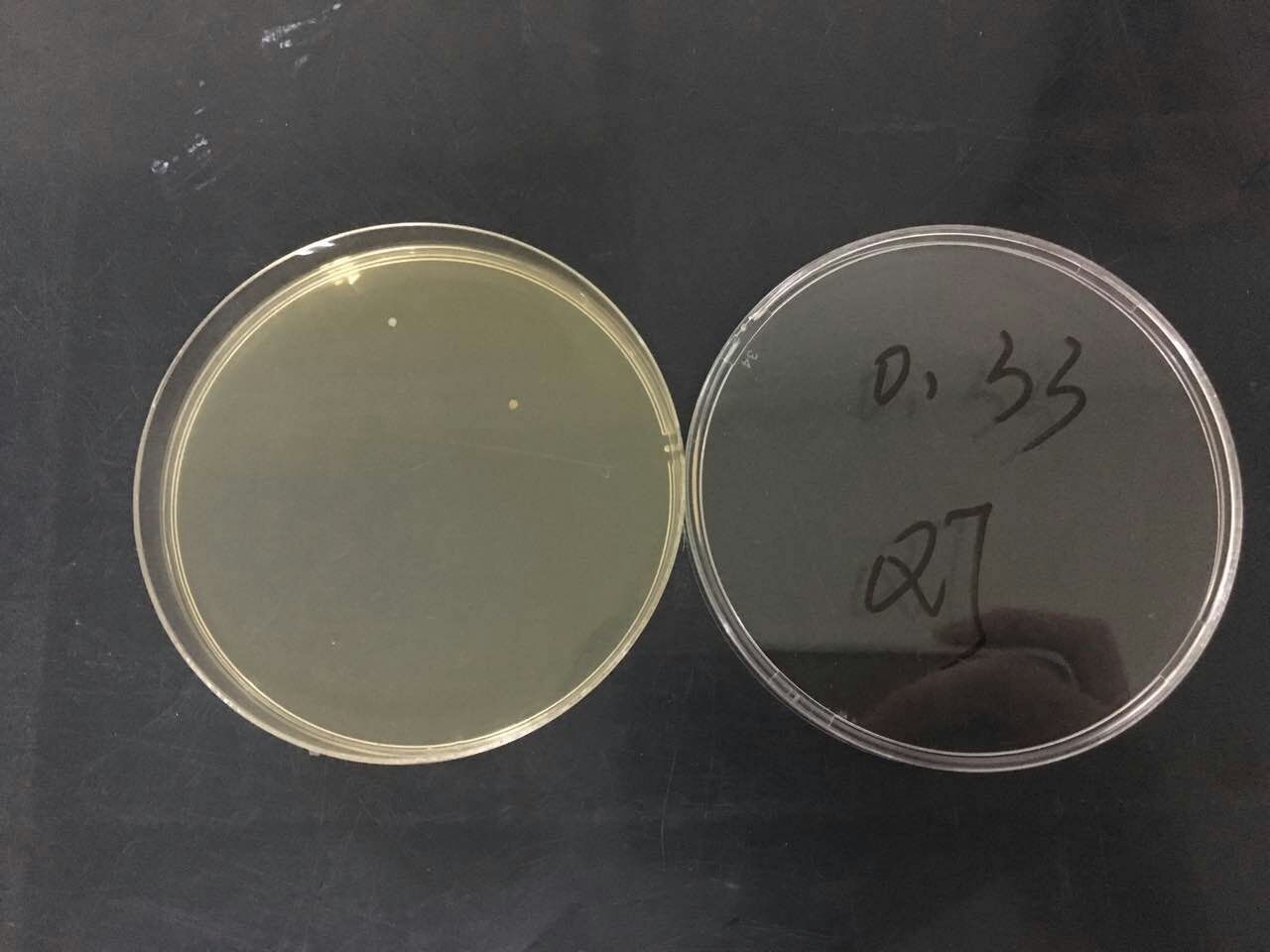
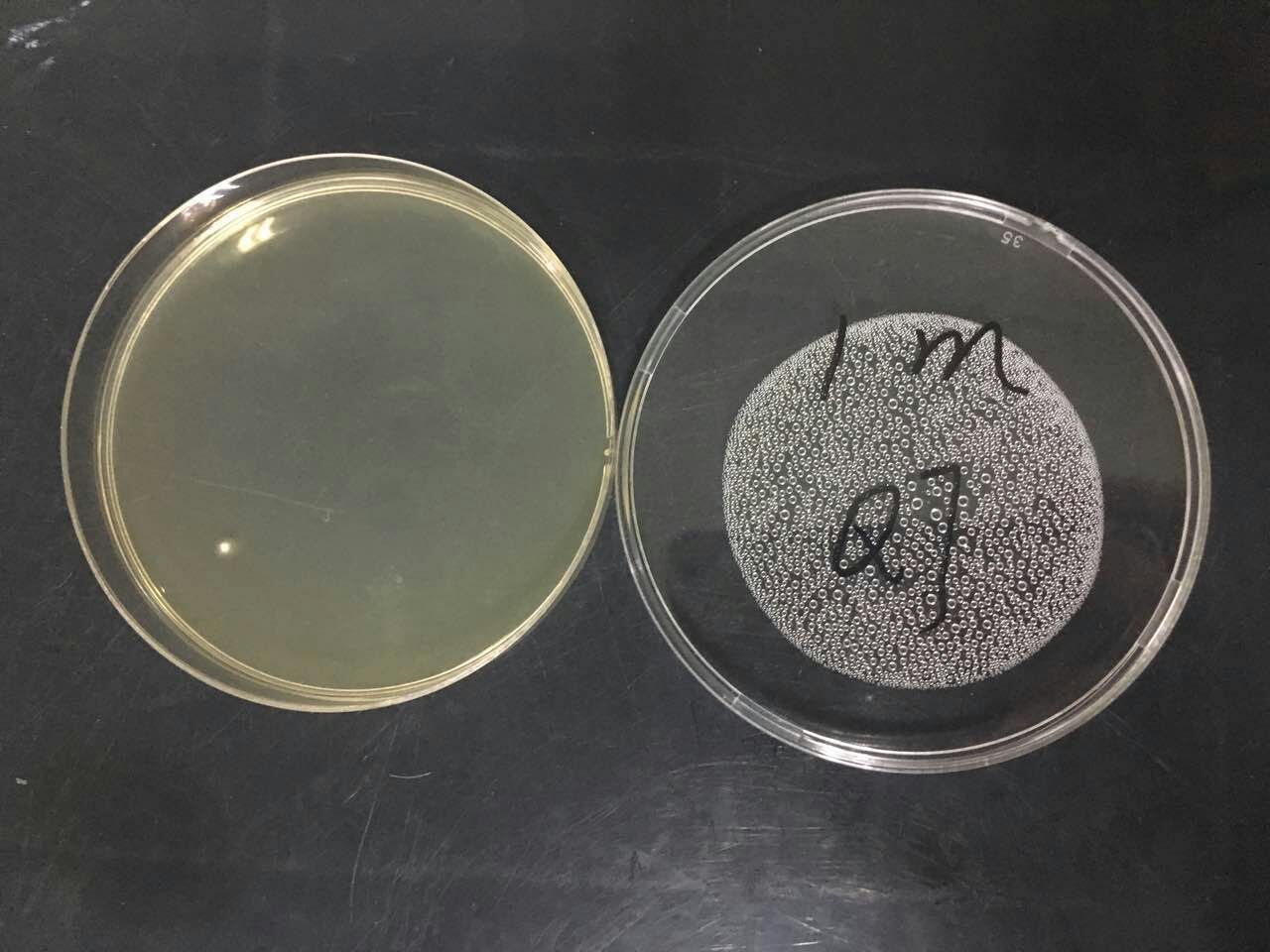
选取三类环境,量取1米距离(参考:飞沫传播1m),在1米的距离上放置四个平皿,分别为0米、1/3米(约0.33米)、2/3米(约0.66米)、1米。实验者在0米距离上方说话1.5分钟(常规说话,旁边有交谈者),之后静止到5分钟。收起平皿,37℃培养48小时,读取结果。结果如下:
实验结论验证:之前环境监测中出现的情况,为采样时附近有交谈者,同时验证1米飞沫传播。
查看全部
我们很想知道这样的情况是如何产生的,首先我们考虑是因为说话,飞沫导致的。于是我们进行了一个小实验:
选取三类环境,量取1米距离(参考:飞沫传播1m),在1米的距离上放置四个平皿,分别为0米、1/3米(约0.33米)、2/3米(约0.66米)、1米。实验者在0米距离上方说话1.5分钟(常规说话,旁边有交谈者),之后静止到5分钟。收起平皿,37℃培养48小时,读取结果。结果如下:
实验结论验证:之前环境监测中出现的情况,为采样时附近有交谈者,同时验证1米飞沫传播。
查看全部
"与护理部共同做好采集血培养标本的质量控制"一文值得学习!
默认分类 • dearhang 发表了文章 • 0 个评论 • 451 次浏览 • 2017-01-03 12:45
与护理部共同做好采集血培养标本的质量控制
邵海枫(南京军区南京总医院临床中心实验科,南京210002)
血液感染危及生命,历来被临床和微生物实验室高度重视。对血液培养的质量控制不仅要提高血液培养的阳性率,还要提高检出感染菌的准确率,排除在整个血液培养过程中影响检测准确率的各种干扰因素。血液培养的全过程分为2个阶段,第一阶段血液标本的采集由临床完成,标本采集送达实验室后的第二阶段由微生物室完成。目前国内绝大部分具有一定规模的综合性医院,微生物实验室都已配备全自动连续监测血液培养仪,在仪器自动发出阳性生长警报之前,实验室无需再进行任何可能造成标本污染的操作。
因此,做好血培养采血过程的质量控制,对防止污染、提高培养阳性率显得极其重要,需要实验室加强与临床尤其是护理部门的沟通,共同完成对此过程的质量监控。
1 与护理部共同完成血液培养标本临床采集的培训检验分析前的质量控制并不是编写完标本采集手册、发放给临床的医生和护士就可以了。细菌培养标本采集所涉及的细节较多,微生物实验室的主管应该主动和护理部联系,给护士长和全院的护理人员讲课,讲解如何选择血培养标本的采集时机,如何提高血培养的阳性率,如何避免采集标本过程中的污染,如何避免将空气注入厌氧血培养瓶,以及各种血培养瓶的性能、领取后的保管方法,标本采集后如何放置和运送等。由于护理人员流动性较大,建议护理部举办的新护士培训课应该有检验分析前质量控制的内容。
2 对护理人员培训的主要内容菌血症患者仅1/3血液培养有阳性结果,如此低的检出率与人体局部的细菌含量、采血时机的掌握、血液的采集量以及是否已使用抗菌药物均相关。
2.1 采集血液标本培养的时机 对于急性的血液感染,应该选择血液中细菌数量最多的时机采血进行培养。理论上说,这一时段通常在寒颤或体温高峰到来之前0.5~1h,但实际较难掌握。可以在寒颤或发热高峰后尽快从不同部位采集2套血培养(10min内完成采集)。急性细菌性心内膜炎应该1~2h内从3个部位采集3套血培养。亚急性细菌性心内膜炎或不明原因的发热应24h内从不同部位采集3套血培养,如24~48h阴性,再次采集2~3套或更多套血培养,以增加检出感染菌的机会。
2.2 采血方法 对疑有菌血症的患者,CLSI不推荐单侧采血,尤其是在首次血培养时更应采集2~3套。如果仅从单侧采血更须注意不得从静脉留置导管采集,否则很难区分阳性结果是否为污染菌引起。2~3套血应从不同部位抽取血液标本。每一部位采集的血液样本分别注入需氧血培养瓶和厌氧血培养瓶,如用蝶形针采血,应先注入需氧瓶,再注入厌氧瓶。完成采血后应先拔出与厌氧瓶连接的针,再拔出刺入患者血管的针,以避免气体进入瓶中。如用针管采血,拔出注射器后,排除针尖的空气和少量血液后,首先注入厌氧瓶,再将余血注入需氧瓶,避免发生最后将余血注入厌氧瓶时同时将空气注入的情况。
2.3 采血量 约50%的菌血症患者血液中细菌量低于1CFU/mL,CLSI推荐从不同部位采集2套血培养,每套2瓶(需氧和厌氧各1瓶),每瓶采集10mL血液。不同的血液培养系统对各自培养瓶的采血量有一定的要求,如BactecFX血培养系统的BactecPlus树脂需氧瓶要求采血8~10mL,Bact/Alert3D全自动血培养系统SA标准瓶要求采血5~10mL。虽然最低采血量有差别,但上限均在10mL或更多,应尽量满足上限的要求。有资料报道采集2套血,可检出90%~95%的菌血症;采集3套血检出率可达95%~99%。
2.4 患者使用抗菌药物情况 总的原则是应在抗菌药物使用前或疗效不佳更换抗菌药物前采血进行培养。但正在使用抗菌药物的患者,有时仍需采血进行培养,此时推荐在下一次给药之前采血,因为此时血液中抗菌药物浓度最低。Towns等报道,已使用抗菌药物的患者用可吸附抗菌药物的树脂瓶,可使血液培养的阳性率增加15%~35%。目前BD公司的树脂瓶中含有2种不同的树脂(白色和棕色),分别为阳离子交换树脂和聚合吸附树脂,可对种类较多的抗菌药物进行化学结合和物理吸附。据称不久还会加入另一种红色的树脂,能够更好地消除抗菌药物的影响。
2.5 导管相关血流感染(catherrelatedbloodstreaminfections,CRBSI) 随着静脉导管技术在临床广泛使用,CRBSI的发病率呈增高趋势。美国每年有超过250000例CRBSI,死亡率达12%~25%。检测导管相关菌血症或真菌血症时,采集血标本方式有拔出导管和保留导管2种。拔出导管时,按检验规定无菌操作剪下尖端5cm送检做半定量培养。需要保留导管的患者可用管腔刷、双侧采血定量培养和双侧采血比较阳性报告时间3种方法。前2种方法需要专门的装置,目前还很少有单位能开展。双侧采血比较仪器报告阳性生长时间,需要分别从外周静脉和静脉导管采集血液进行培养,所用的血培养瓶和采血量要一致。若外周血阳性早于导管血2h以上,导管可能不是菌血症的来源,此时可以考虑保留导管;若导管血阳性早于外周血2h以上,导管可能是菌血症的来源;若只有一侧阳性,则可能为污染。
3 微生物实验室需要参与的工作微生物室的工作人员要对血培养的结果进行质量跟踪,及时反馈信息,及时表扬和批评,帮助护理部门做好这项工作。
3.1 设置采血瓶数 尽管CLSI推荐从不同部位采集2套血进行培养,但考虑中国的国情,不同地区发展水平的差异和患者的经济承受能力,在有些医院和对有些患者可以采用双侧各1瓶或双侧3瓶的方法。双侧各1瓶,可以是两侧均为普通培养瓶的模式,也可以一侧为普通瓶、另一侧为厌氧瓶的模式。仅用普通瓶可能会漏检厌氧菌感染,但对是否常规进行厌氧菌培养还有一些争议;一侧普通瓶、一侧厌氧瓶模式,对于常见的污染菌如葡萄球菌等往往为兼性厌氧细菌,可用单侧生长现象来排除污染;但对易造成污染的专性需氧菌(如棒状杆菌属),判定是否为抽血污染仍存在困难。双侧3瓶为2个普通瓶和1个厌氧瓶,采集时普通瓶需分在两侧采集。这种设置兼顾了需氧菌和厌氧的细菌引起的感染。儿童采血瓶的数量一直是较多困扰的问题,在很多医院很难推广双侧采血,而儿童尤其是婴幼儿因采血困难往往会造成较高的污染率和较低的阳性率。
3.2 对采血流程进行规范化管控 要制作图文并茂、简明扼要的流程卡片,发到每一个护理单元,规范操作流程。要求临床采集完成后,对采血瓶进行标识,内容包括采血部位、采血时间和采集人,避免错误地将一侧采集的血注入2个相同类型的培养瓶中(如均为普通瓶或厌氧瓶),这样的情况常发生在刚开始推广双侧采血或新护士操作时。
3.3 信息反馈 要将血培养采集的污染率和采集方法的错误率及时反馈给临床,每隔一段时间(1~3个月)进行1次统计并将数据提交护理部,请护理部帮助对污染率和错误率较高的护理单元和个人进行批评和再培训,对操作质量好的进行表扬。有专家建议,如果污染率持续超过3%,应当培训专职采集血培养的护士以降低污染率。对血培养标本采集进行质量跟踪,虽然会给微生物实验室带来许多琐碎繁杂的工作,但为了保证临床能获得准确真实的结果,患者能得到及时正确的治疗,每个微生物工作者都应肩负起责任,切不可认为采集血培养标本是临床的工作,与微生物室自身的工作质量无关。 查看全部
邵海枫(南京军区南京总医院临床中心实验科,南京210002)
血液感染危及生命,历来被临床和微生物实验室高度重视。对血液培养的质量控制不仅要提高血液培养的阳性率,还要提高检出感染菌的准确率,排除在整个血液培养过程中影响检测准确率的各种干扰因素。血液培养的全过程分为2个阶段,第一阶段血液标本的采集由临床完成,标本采集送达实验室后的第二阶段由微生物室完成。目前国内绝大部分具有一定规模的综合性医院,微生物实验室都已配备全自动连续监测血液培养仪,在仪器自动发出阳性生长警报之前,实验室无需再进行任何可能造成标本污染的操作。
因此,做好血培养采血过程的质量控制,对防止污染、提高培养阳性率显得极其重要,需要实验室加强与临床尤其是护理部门的沟通,共同完成对此过程的质量监控。
1 与护理部共同完成血液培养标本临床采集的培训检验分析前的质量控制并不是编写完标本采集手册、发放给临床的医生和护士就可以了。细菌培养标本采集所涉及的细节较多,微生物实验室的主管应该主动和护理部联系,给护士长和全院的护理人员讲课,讲解如何选择血培养标本的采集时机,如何提高血培养的阳性率,如何避免采集标本过程中的污染,如何避免将空气注入厌氧血培养瓶,以及各种血培养瓶的性能、领取后的保管方法,标本采集后如何放置和运送等。由于护理人员流动性较大,建议护理部举办的新护士培训课应该有检验分析前质量控制的内容。
2 对护理人员培训的主要内容菌血症患者仅1/3血液培养有阳性结果,如此低的检出率与人体局部的细菌含量、采血时机的掌握、血液的采集量以及是否已使用抗菌药物均相关。
2.1 采集血液标本培养的时机 对于急性的血液感染,应该选择血液中细菌数量最多的时机采血进行培养。理论上说,这一时段通常在寒颤或体温高峰到来之前0.5~1h,但实际较难掌握。可以在寒颤或发热高峰后尽快从不同部位采集2套血培养(10min内完成采集)。急性细菌性心内膜炎应该1~2h内从3个部位采集3套血培养。亚急性细菌性心内膜炎或不明原因的发热应24h内从不同部位采集3套血培养,如24~48h阴性,再次采集2~3套或更多套血培养,以增加检出感染菌的机会。
2.2 采血方法 对疑有菌血症的患者,CLSI不推荐单侧采血,尤其是在首次血培养时更应采集2~3套。如果仅从单侧采血更须注意不得从静脉留置导管采集,否则很难区分阳性结果是否为污染菌引起。2~3套血应从不同部位抽取血液标本。每一部位采集的血液样本分别注入需氧血培养瓶和厌氧血培养瓶,如用蝶形针采血,应先注入需氧瓶,再注入厌氧瓶。完成采血后应先拔出与厌氧瓶连接的针,再拔出刺入患者血管的针,以避免气体进入瓶中。如用针管采血,拔出注射器后,排除针尖的空气和少量血液后,首先注入厌氧瓶,再将余血注入需氧瓶,避免发生最后将余血注入厌氧瓶时同时将空气注入的情况。
2.3 采血量 约50%的菌血症患者血液中细菌量低于1CFU/mL,CLSI推荐从不同部位采集2套血培养,每套2瓶(需氧和厌氧各1瓶),每瓶采集10mL血液。不同的血液培养系统对各自培养瓶的采血量有一定的要求,如BactecFX血培养系统的BactecPlus树脂需氧瓶要求采血8~10mL,Bact/Alert3D全自动血培养系统SA标准瓶要求采血5~10mL。虽然最低采血量有差别,但上限均在10mL或更多,应尽量满足上限的要求。有资料报道采集2套血,可检出90%~95%的菌血症;采集3套血检出率可达95%~99%。
2.4 患者使用抗菌药物情况 总的原则是应在抗菌药物使用前或疗效不佳更换抗菌药物前采血进行培养。但正在使用抗菌药物的患者,有时仍需采血进行培养,此时推荐在下一次给药之前采血,因为此时血液中抗菌药物浓度最低。Towns等报道,已使用抗菌药物的患者用可吸附抗菌药物的树脂瓶,可使血液培养的阳性率增加15%~35%。目前BD公司的树脂瓶中含有2种不同的树脂(白色和棕色),分别为阳离子交换树脂和聚合吸附树脂,可对种类较多的抗菌药物进行化学结合和物理吸附。据称不久还会加入另一种红色的树脂,能够更好地消除抗菌药物的影响。
2.5 导管相关血流感染(catherrelatedbloodstreaminfections,CRBSI) 随着静脉导管技术在临床广泛使用,CRBSI的发病率呈增高趋势。美国每年有超过250000例CRBSI,死亡率达12%~25%。检测导管相关菌血症或真菌血症时,采集血标本方式有拔出导管和保留导管2种。拔出导管时,按检验规定无菌操作剪下尖端5cm送检做半定量培养。需要保留导管的患者可用管腔刷、双侧采血定量培养和双侧采血比较阳性报告时间3种方法。前2种方法需要专门的装置,目前还很少有单位能开展。双侧采血比较仪器报告阳性生长时间,需要分别从外周静脉和静脉导管采集血液进行培养,所用的血培养瓶和采血量要一致。若外周血阳性早于导管血2h以上,导管可能不是菌血症的来源,此时可以考虑保留导管;若导管血阳性早于外周血2h以上,导管可能是菌血症的来源;若只有一侧阳性,则可能为污染。
3 微生物实验室需要参与的工作微生物室的工作人员要对血培养的结果进行质量跟踪,及时反馈信息,及时表扬和批评,帮助护理部门做好这项工作。
3.1 设置采血瓶数 尽管CLSI推荐从不同部位采集2套血进行培养,但考虑中国的国情,不同地区发展水平的差异和患者的经济承受能力,在有些医院和对有些患者可以采用双侧各1瓶或双侧3瓶的方法。双侧各1瓶,可以是两侧均为普通培养瓶的模式,也可以一侧为普通瓶、另一侧为厌氧瓶的模式。仅用普通瓶可能会漏检厌氧菌感染,但对是否常规进行厌氧菌培养还有一些争议;一侧普通瓶、一侧厌氧瓶模式,对于常见的污染菌如葡萄球菌等往往为兼性厌氧细菌,可用单侧生长现象来排除污染;但对易造成污染的专性需氧菌(如棒状杆菌属),判定是否为抽血污染仍存在困难。双侧3瓶为2个普通瓶和1个厌氧瓶,采集时普通瓶需分在两侧采集。这种设置兼顾了需氧菌和厌氧的细菌引起的感染。儿童采血瓶的数量一直是较多困扰的问题,在很多医院很难推广双侧采血,而儿童尤其是婴幼儿因采血困难往往会造成较高的污染率和较低的阳性率。
3.2 对采血流程进行规范化管控 要制作图文并茂、简明扼要的流程卡片,发到每一个护理单元,规范操作流程。要求临床采集完成后,对采血瓶进行标识,内容包括采血部位、采血时间和采集人,避免错误地将一侧采集的血注入2个相同类型的培养瓶中(如均为普通瓶或厌氧瓶),这样的情况常发生在刚开始推广双侧采血或新护士操作时。
3.3 信息反馈 要将血培养采集的污染率和采集方法的错误率及时反馈给临床,每隔一段时间(1~3个月)进行1次统计并将数据提交护理部,请护理部帮助对污染率和错误率较高的护理单元和个人进行批评和再培训,对操作质量好的进行表扬。有专家建议,如果污染率持续超过3%,应当培训专职采集血培养的护士以降低污染率。对血培养标本采集进行质量跟踪,虽然会给微生物实验室带来许多琐碎繁杂的工作,但为了保证临床能获得准确真实的结果,患者能得到及时正确的治疗,每个微生物工作者都应肩负起责任,切不可认为采集血培养标本是临床的工作,与微生物室自身的工作质量无关。 查看全部
与护理部共同做好采集血培养标本的质量控制
邵海枫(南京军区南京总医院临床中心实验科,南京210002)
血液感染危及生命,历来被临床和微生物实验室高度重视。对血液培养的质量控制不仅要提高血液培养的阳性率,还要提高检出感染菌的准确率,排除在整个血液培养过程中影响检测准确率的各种干扰因素。血液培养的全过程分为2个阶段,第一阶段血液标本的采集由临床完成,标本采集送达实验室后的第二阶段由微生物室完成。目前国内绝大部分具有一定规模的综合性医院,微生物实验室都已配备全自动连续监测血液培养仪,在仪器自动发出阳性生长警报之前,实验室无需再进行任何可能造成标本污染的操作。
因此,做好血培养采血过程的质量控制,对防止污染、提高培养阳性率显得极其重要,需要实验室加强与临床尤其是护理部门的沟通,共同完成对此过程的质量监控。
1 与护理部共同完成血液培养标本临床采集的培训检验分析前的质量控制并不是编写完标本采集手册、发放给临床的医生和护士就可以了。细菌培养标本采集所涉及的细节较多,微生物实验室的主管应该主动和护理部联系,给护士长和全院的护理人员讲课,讲解如何选择血培养标本的采集时机,如何提高血培养的阳性率,如何避免采集标本过程中的污染,如何避免将空气注入厌氧血培养瓶,以及各种血培养瓶的性能、领取后的保管方法,标本采集后如何放置和运送等。由于护理人员流动性较大,建议护理部举办的新护士培训课应该有检验分析前质量控制的内容。
2 对护理人员培训的主要内容菌血症患者仅1/3血液培养有阳性结果,如此低的检出率与人体局部的细菌含量、采血时机的掌握、血液的采集量以及是否已使用抗菌药物均相关。
2.1 采集血液标本培养的时机 对于急性的血液感染,应该选择血液中细菌数量最多的时机采血进行培养。理论上说,这一时段通常在寒颤或体温高峰到来之前0.5~1h,但实际较难掌握。可以在寒颤或发热高峰后尽快从不同部位采集2套血培养(10min内完成采集)。急性细菌性心内膜炎应该1~2h内从3个部位采集3套血培养。亚急性细菌性心内膜炎或不明原因的发热应24h内从不同部位采集3套血培养,如24~48h阴性,再次采集2~3套或更多套血培养,以增加检出感染菌的机会。
2.2 采血方法 对疑有菌血症的患者,CLSI不推荐单侧采血,尤其是在首次血培养时更应采集2~3套。如果仅从单侧采血更须注意不得从静脉留置导管采集,否则很难区分阳性结果是否为污染菌引起。2~3套血应从不同部位抽取血液标本。每一部位采集的血液样本分别注入需氧血培养瓶和厌氧血培养瓶,如用蝶形针采血,应先注入需氧瓶,再注入厌氧瓶。完成采血后应先拔出与厌氧瓶连接的针,再拔出刺入患者血管的针,以避免气体进入瓶中。如用针管采血,拔出注射器后,排除针尖的空气和少量血液后,首先注入厌氧瓶,再将余血注入需氧瓶,避免发生最后将余血注入厌氧瓶时同时将空气注入的情况。
2.3 采血量 约50%的菌血症患者血液中细菌量低于1CFU/mL,CLSI推荐从不同部位采集2套血培养,每套2瓶(需氧和厌氧各1瓶),每瓶采集10mL血液。不同的血液培养系统对各自培养瓶的采血量有一定的要求,如BactecFX血培养系统的BactecPlus树脂需氧瓶要求采血8~10mL,Bact/Alert3D全自动血培养系统SA标准瓶要求采血5~10mL。虽然最低采血量有差别,但上限均在10mL或更多,应尽量满足上限的要求。有资料报道采集2套血,可检出90%~95%的菌血症;采集3套血检出率可达95%~99%。
2.4 患者使用抗菌药物情况 总的原则是应在抗菌药物使用前或疗效不佳更换抗菌药物前采血进行培养。但正在使用抗菌药物的患者,有时仍需采血进行培养,此时推荐在下一次给药之前采血,因为此时血液中抗菌药物浓度最低。Towns等报道,已使用抗菌药物的患者用可吸附抗菌药物的树脂瓶,可使血液培养的阳性率增加15%~35%。目前BD公司的树脂瓶中含有2种不同的树脂(白色和棕色),分别为阳离子交换树脂和聚合吸附树脂,可对种类较多的抗菌药物进行化学结合和物理吸附。据称不久还会加入另一种红色的树脂,能够更好地消除抗菌药物的影响。
2.5 导管相关血流感染(catherrelatedbloodstreaminfections,CRBSI) 随着静脉导管技术在临床广泛使用,CRBSI的发病率呈增高趋势。美国每年有超过250000例CRBSI,死亡率达12%~25%。检测导管相关菌血症或真菌血症时,采集血标本方式有拔出导管和保留导管2种。拔出导管时,按检验规定无菌操作剪下尖端5cm送检做半定量培养。需要保留导管的患者可用管腔刷、双侧采血定量培养和双侧采血比较阳性报告时间3种方法。前2种方法需要专门的装置,目前还很少有单位能开展。双侧采血比较仪器报告阳性生长时间,需要分别从外周静脉和静脉导管采集血液进行培养,所用的血培养瓶和采血量要一致。若外周血阳性早于导管血2h以上,导管可能不是菌血症的来源,此时可以考虑保留导管;若导管血阳性早于外周血2h以上,导管可能是菌血症的来源;若只有一侧阳性,则可能为污染。
3 微生物实验室需要参与的工作微生物室的工作人员要对血培养的结果进行质量跟踪,及时反馈信息,及时表扬和批评,帮助护理部门做好这项工作。
3.1 设置采血瓶数 尽管CLSI推荐从不同部位采集2套血进行培养,但考虑中国的国情,不同地区发展水平的差异和患者的经济承受能力,在有些医院和对有些患者可以采用双侧各1瓶或双侧3瓶的方法。双侧各1瓶,可以是两侧均为普通培养瓶的模式,也可以一侧为普通瓶、另一侧为厌氧瓶的模式。仅用普通瓶可能会漏检厌氧菌感染,但对是否常规进行厌氧菌培养还有一些争议;一侧普通瓶、一侧厌氧瓶模式,对于常见的污染菌如葡萄球菌等往往为兼性厌氧细菌,可用单侧生长现象来排除污染;但对易造成污染的专性需氧菌(如棒状杆菌属),判定是否为抽血污染仍存在困难。双侧3瓶为2个普通瓶和1个厌氧瓶,采集时普通瓶需分在两侧采集。这种设置兼顾了需氧菌和厌氧的细菌引起的感染。儿童采血瓶的数量一直是较多困扰的问题,在很多医院很难推广双侧采血,而儿童尤其是婴幼儿因采血困难往往会造成较高的污染率和较低的阳性率。
3.2 对采血流程进行规范化管控 要制作图文并茂、简明扼要的流程卡片,发到每一个护理单元,规范操作流程。要求临床采集完成后,对采血瓶进行标识,内容包括采血部位、采血时间和采集人,避免错误地将一侧采集的血注入2个相同类型的培养瓶中(如均为普通瓶或厌氧瓶),这样的情况常发生在刚开始推广双侧采血或新护士操作时。
3.3 信息反馈 要将血培养采集的污染率和采集方法的错误率及时反馈给临床,每隔一段时间(1~3个月)进行1次统计并将数据提交护理部,请护理部帮助对污染率和错误率较高的护理单元和个人进行批评和再培训,对操作质量好的进行表扬。有专家建议,如果污染率持续超过3%,应当培训专职采集血培养的护士以降低污染率。对血培养标本采集进行质量跟踪,虽然会给微生物实验室带来许多琐碎繁杂的工作,但为了保证临床能获得准确真实的结果,患者能得到及时正确的治疗,每个微生物工作者都应肩负起责任,切不可认为采集血培养标本是临床的工作,与微生物室自身的工作质量无关。
[转帖] 痰标本留取的正确打开方式!
默认分类 • dearhang 发表了文章 • 0 个评论 • 422 次浏览 • 2017-01-03 11:50
痰标本留取的正确打开方式!
医学界检验频道 mp2016-08-2919:46:57
标本采集的正确与否直接影响到最终的结果!
来源:医学界呼吸频道
在鉴定下呼吸道感染病原体时,咳出的痰液标本虽然应用最早,而且目前仍然十分广泛,但也是最受争议的微生物学标本,通俗的讲,这可能就是一个鸡肋,甚至鸡肋都不如。
谁需要留痰?
上面也说了,几乎所有呼吸科病人都需要留痰,这并非夸张。凡有痰液的下呼吸道感染患者均可留痰进行涂片和培养。痰标本可用于普通细菌、分支杆菌、真菌和军团菌的检测,但不适用于检测厌氧菌。
插一句:有同学问,为什么痰涂片都是找细菌、真菌、抗酸杆菌,而不找厌氧菌呢?老实说,这个问题笔者曾经也想过,现在把正确解释奉上:引起下呼吸道感染的厌氧菌多为条件致病菌,而口咽部有大量厌氧菌定植,如果痰涂片找厌氧菌,那么不可避免分不清敌友,混淆视听,所以采集彻底避免上呼吸道菌群污染的标本才是准确建立厌氧菌感染病原学诊断的关键。而普通的咳痰、经口咽部活支气管镜活人工气道的下呼吸道吸引物甚至是普通支气管肺泡灌洗液,均不能用于厌氧菌检验。目前推崇的主要为防污染采样毛刷(PSB)、经皮肤针刺吸引物(TNA)。由此可以推测,我国临床厌氧菌的检验普及率非常低,反正笔者没见过(呵呵,见识短),据资料显示,目前也仅有少数大医院开展厌氧菌检测,而且检验质量也不大靠谱。
如何正确留痰?
这是非常重要的步骤,而绝大多数时候都是容易被我们忽略的步骤。老实说,病原学诊断率是很低的,临床上经常没有针对性地使用敏感抗菌药物,大多数情况都是经验用药,理想与现实是有距离的。由于解剖结构的特殊性和病原体的复杂性,准确开展下呼吸道感染的病原学诊断并非易事。
方法:(1)抗生素前采集,若患者有假牙,应摘掉牙托,清洁口腔(刷牙或漱口),深部咳出痰液;(2)留痰时,应在医护人员直视下采集。(3)痰标本采集后1-2h内必须送检,因为室温下2h会降低肺炎链球菌、流感嗜血杆菌等苛养菌的分离率,而定植于上呼吸道的非致病菌以及许多条件致病菌(比如铜绿假单胞菌)可过度生长。(4)普通肺炎的话,可每天送检一次痰标本,连续2-3天。
我们很少直接告诉病人要如何正确留痰,我们做的只是医嘱上画几笔,然后护士告诉患者该如何操作,护士的告知是否妥当,直接影响到标本的质量。甚至有的长期卧床的病人,留取痰标本的任务有可能光荣地落到了护工的手上(这当然是不合规的),这些护工,有可能直接撬开患者嘴巴,随便搞点口水下来,OK,这就是痰标本,然后我们对着检验报告结果的“铜绿假单胞菌”发愁,而当药敏显示无药可用的时候,就飞机大炮一起上。我的天啊!
痰标本的评估
痰标本采集是很简单,但要真正做到合乎规矩的就少之又少了。由于咳痰受到口咽部定植菌污染,分离到的细菌往往不能真正代表下呼吸道感染的致病菌。痰培养结果的解释应结合临床表现、影像学改变及所发现的微生物的致病力等等因素来综合评估。
痰涂片(找细菌、真菌、抗酸杆菌)的时候,结果常常是这样的:革兰阳性菌(+++)、革兰阴性菌(+++),这其实并没有多少意义,但有的科室部分医生一看到几个加号,就开始不得了了,实在让人不敢恭维。如果患者没有得到专业指导,则随便糊弄出一口痰,更多的时候可能只是一坨口水,而口腔和口咽部的正常菌群是非常多的,而且致病力很低,比如草绿色链球菌、肠球菌等,非常常见,而致病力极其低微,这样的结果其实是没有实际用途的。
那有没有办法不让口咽部的正常菌群污染到标本呢?当然有,比如经气管穿刺吸引物、经支气管镜采样等,直接采集下呼吸道标本而不受上呼吸道正常菌群污染,当然结果比痰标本要可信得多,但这都是侵入性的检查,有点杀鸡用牛刀的感觉,除非病情需要,否则不会轻易实施。再说,价格也相差十万八千里,不可能天天都做啊。
痰涂片、痰培养需一起开医嘱
由于人体喉以上呼吸道黏膜表面及其分泌物含有众多微生物,唾液含菌量非常多,老年、重症或住院病人的上呼吸道定植致病菌更多,致使途径口咽部的咳痰经常受到污染,影响结果判定。痰标本的优劣,或者是否能避开上呼吸道菌群污染而采集下呼吸道感染部位的标本,直接影响病原学诊断的准确性和可靠性。再次强调,由于咳痰非常容易受到口咽部定植菌污染,分离到的细菌往往不能真正代表下呼吸道感染的病原菌,为减少污染,痰培养前需要做标本质量评估,即细胞学筛选,虽然部分痰标本通过肉眼观察其外观如黏液和脓性成分,可大致了解受检标本的质量,但仅凭此点尚不足,痰涂片细胞学检查判断标本受污染程度则是一种较为可靠的方法。对于要求细菌培养的痰标本都要常规涂片革兰染色,明确唾液对标本的污染程度和有无必要做细菌培养。
而非呼吸科的其他科室,很少会开“痰涂片”这样的医嘱,都是直接开“痰培养”,认为这是省事。这当然是不正确的,痰涂片很重要,可以简单认为它是“开路人”,“排头兵”等,过了它这关,下面的培养才有意义。笔者也联系过检验科的同事,有人认为,即使医生不开“痰涂片”的医嘱,检验科的同事也会涂片染色检查。但是不是所有地方所有人都这样,笔者就不敢说了。
一般认为,来自下呼吸道的合格痰标本应是含有脓细胞和支气管柱状上皮细胞较多,而受到唾液污染严重的不合格的标本则来自颊黏膜的扁平鳞状上皮细胞较多,镜检筛选制度(痰涂片),剔除代表上呼吸道污染的标本,这是非常有益的。下图介绍的是我国的合格的痰标本的标准的规定。
总的来说,痰涂片、痰标本对临床是意义的,尤其是痰涂片看到抗酸杆菌的时候,但痰液标本的质量控制,才是更为关键的。否则,痰培养的结果可能会误导临床。
来源:搜狐健康网
查看全部
医学界检验频道 mp2016-08-2919:46:57
标本采集的正确与否直接影响到最终的结果!
来源:医学界呼吸频道
在鉴定下呼吸道感染病原体时,咳出的痰液标本虽然应用最早,而且目前仍然十分广泛,但也是最受争议的微生物学标本,通俗的讲,这可能就是一个鸡肋,甚至鸡肋都不如。
谁需要留痰?
上面也说了,几乎所有呼吸科病人都需要留痰,这并非夸张。凡有痰液的下呼吸道感染患者均可留痰进行涂片和培养。痰标本可用于普通细菌、分支杆菌、真菌和军团菌的检测,但不适用于检测厌氧菌。
插一句:有同学问,为什么痰涂片都是找细菌、真菌、抗酸杆菌,而不找厌氧菌呢?老实说,这个问题笔者曾经也想过,现在把正确解释奉上:引起下呼吸道感染的厌氧菌多为条件致病菌,而口咽部有大量厌氧菌定植,如果痰涂片找厌氧菌,那么不可避免分不清敌友,混淆视听,所以采集彻底避免上呼吸道菌群污染的标本才是准确建立厌氧菌感染病原学诊断的关键。而普通的咳痰、经口咽部活支气管镜活人工气道的下呼吸道吸引物甚至是普通支气管肺泡灌洗液,均不能用于厌氧菌检验。目前推崇的主要为防污染采样毛刷(PSB)、经皮肤针刺吸引物(TNA)。由此可以推测,我国临床厌氧菌的检验普及率非常低,反正笔者没见过(呵呵,见识短),据资料显示,目前也仅有少数大医院开展厌氧菌检测,而且检验质量也不大靠谱。
如何正确留痰?
这是非常重要的步骤,而绝大多数时候都是容易被我们忽略的步骤。老实说,病原学诊断率是很低的,临床上经常没有针对性地使用敏感抗菌药物,大多数情况都是经验用药,理想与现实是有距离的。由于解剖结构的特殊性和病原体的复杂性,准确开展下呼吸道感染的病原学诊断并非易事。
方法:(1)抗生素前采集,若患者有假牙,应摘掉牙托,清洁口腔(刷牙或漱口),深部咳出痰液;(2)留痰时,应在医护人员直视下采集。(3)痰标本采集后1-2h内必须送检,因为室温下2h会降低肺炎链球菌、流感嗜血杆菌等苛养菌的分离率,而定植于上呼吸道的非致病菌以及许多条件致病菌(比如铜绿假单胞菌)可过度生长。(4)普通肺炎的话,可每天送检一次痰标本,连续2-3天。
我们很少直接告诉病人要如何正确留痰,我们做的只是医嘱上画几笔,然后护士告诉患者该如何操作,护士的告知是否妥当,直接影响到标本的质量。甚至有的长期卧床的病人,留取痰标本的任务有可能光荣地落到了护工的手上(这当然是不合规的),这些护工,有可能直接撬开患者嘴巴,随便搞点口水下来,OK,这就是痰标本,然后我们对着检验报告结果的“铜绿假单胞菌”发愁,而当药敏显示无药可用的时候,就飞机大炮一起上。我的天啊!
痰标本的评估
痰标本采集是很简单,但要真正做到合乎规矩的就少之又少了。由于咳痰受到口咽部定植菌污染,分离到的细菌往往不能真正代表下呼吸道感染的致病菌。痰培养结果的解释应结合临床表现、影像学改变及所发现的微生物的致病力等等因素来综合评估。
痰涂片(找细菌、真菌、抗酸杆菌)的时候,结果常常是这样的:革兰阳性菌(+++)、革兰阴性菌(+++),这其实并没有多少意义,但有的科室部分医生一看到几个加号,就开始不得了了,实在让人不敢恭维。如果患者没有得到专业指导,则随便糊弄出一口痰,更多的时候可能只是一坨口水,而口腔和口咽部的正常菌群是非常多的,而且致病力很低,比如草绿色链球菌、肠球菌等,非常常见,而致病力极其低微,这样的结果其实是没有实际用途的。
那有没有办法不让口咽部的正常菌群污染到标本呢?当然有,比如经气管穿刺吸引物、经支气管镜采样等,直接采集下呼吸道标本而不受上呼吸道正常菌群污染,当然结果比痰标本要可信得多,但这都是侵入性的检查,有点杀鸡用牛刀的感觉,除非病情需要,否则不会轻易实施。再说,价格也相差十万八千里,不可能天天都做啊。
痰涂片、痰培养需一起开医嘱
由于人体喉以上呼吸道黏膜表面及其分泌物含有众多微生物,唾液含菌量非常多,老年、重症或住院病人的上呼吸道定植致病菌更多,致使途径口咽部的咳痰经常受到污染,影响结果判定。痰标本的优劣,或者是否能避开上呼吸道菌群污染而采集下呼吸道感染部位的标本,直接影响病原学诊断的准确性和可靠性。再次强调,由于咳痰非常容易受到口咽部定植菌污染,分离到的细菌往往不能真正代表下呼吸道感染的病原菌,为减少污染,痰培养前需要做标本质量评估,即细胞学筛选,虽然部分痰标本通过肉眼观察其外观如黏液和脓性成分,可大致了解受检标本的质量,但仅凭此点尚不足,痰涂片细胞学检查判断标本受污染程度则是一种较为可靠的方法。对于要求细菌培养的痰标本都要常规涂片革兰染色,明确唾液对标本的污染程度和有无必要做细菌培养。
而非呼吸科的其他科室,很少会开“痰涂片”这样的医嘱,都是直接开“痰培养”,认为这是省事。这当然是不正确的,痰涂片很重要,可以简单认为它是“开路人”,“排头兵”等,过了它这关,下面的培养才有意义。笔者也联系过检验科的同事,有人认为,即使医生不开“痰涂片”的医嘱,检验科的同事也会涂片染色检查。但是不是所有地方所有人都这样,笔者就不敢说了。
一般认为,来自下呼吸道的合格痰标本应是含有脓细胞和支气管柱状上皮细胞较多,而受到唾液污染严重的不合格的标本则来自颊黏膜的扁平鳞状上皮细胞较多,镜检筛选制度(痰涂片),剔除代表上呼吸道污染的标本,这是非常有益的。下图介绍的是我国的合格的痰标本的标准的规定。
总的来说,痰涂片、痰标本对临床是意义的,尤其是痰涂片看到抗酸杆菌的时候,但痰液标本的质量控制,才是更为关键的。否则,痰培养的结果可能会误导临床。
来源:搜狐健康网
查看全部
痰标本留取的正确打开方式!
医学界检验频道 mp2016-08-2919:46:57
标本采集的正确与否直接影响到最终的结果!
来源:医学界呼吸频道
在鉴定下呼吸道感染病原体时,咳出的痰液标本虽然应用最早,而且目前仍然十分广泛,但也是最受争议的微生物学标本,通俗的讲,这可能就是一个鸡肋,甚至鸡肋都不如。
谁需要留痰?
上面也说了,几乎所有呼吸科病人都需要留痰,这并非夸张。凡有痰液的下呼吸道感染患者均可留痰进行涂片和培养。痰标本可用于普通细菌、分支杆菌、真菌和军团菌的检测,但不适用于检测厌氧菌。
插一句:有同学问,为什么痰涂片都是找细菌、真菌、抗酸杆菌,而不找厌氧菌呢?老实说,这个问题笔者曾经也想过,现在把正确解释奉上:引起下呼吸道感染的厌氧菌多为条件致病菌,而口咽部有大量厌氧菌定植,如果痰涂片找厌氧菌,那么不可避免分不清敌友,混淆视听,所以采集彻底避免上呼吸道菌群污染的标本才是准确建立厌氧菌感染病原学诊断的关键。而普通的咳痰、经口咽部活支气管镜活人工气道的下呼吸道吸引物甚至是普通支气管肺泡灌洗液,均不能用于厌氧菌检验。目前推崇的主要为防污染采样毛刷(PSB)、经皮肤针刺吸引物(TNA)。由此可以推测,我国临床厌氧菌的检验普及率非常低,反正笔者没见过(呵呵,见识短),据资料显示,目前也仅有少数大医院开展厌氧菌检测,而且检验质量也不大靠谱。
如何正确留痰?
这是非常重要的步骤,而绝大多数时候都是容易被我们忽略的步骤。老实说,病原学诊断率是很低的,临床上经常没有针对性地使用敏感抗菌药物,大多数情况都是经验用药,理想与现实是有距离的。由于解剖结构的特殊性和病原体的复杂性,准确开展下呼吸道感染的病原学诊断并非易事。
方法:(1)抗生素前采集,若患者有假牙,应摘掉牙托,清洁口腔(刷牙或漱口),深部咳出痰液;(2)留痰时,应在医护人员直视下采集。(3)痰标本采集后1-2h内必须送检,因为室温下2h会降低肺炎链球菌、流感嗜血杆菌等苛养菌的分离率,而定植于上呼吸道的非致病菌以及许多条件致病菌(比如铜绿假单胞菌)可过度生长。(4)普通肺炎的话,可每天送检一次痰标本,连续2-3天。
我们很少直接告诉病人要如何正确留痰,我们做的只是医嘱上画几笔,然后护士告诉患者该如何操作,护士的告知是否妥当,直接影响到标本的质量。甚至有的长期卧床的病人,留取痰标本的任务有可能光荣地落到了护工的手上(这当然是不合规的),这些护工,有可能直接撬开患者嘴巴,随便搞点口水下来,OK,这就是痰标本,然后我们对着检验报告结果的“铜绿假单胞菌”发愁,而当药敏显示无药可用的时候,就飞机大炮一起上。我的天啊!
痰标本的评估
痰标本采集是很简单,但要真正做到合乎规矩的就少之又少了。由于咳痰受到口咽部定植菌污染,分离到的细菌往往不能真正代表下呼吸道感染的致病菌。痰培养结果的解释应结合临床表现、影像学改变及所发现的微生物的致病力等等因素来综合评估。
痰涂片(找细菌、真菌、抗酸杆菌)的时候,结果常常是这样的:革兰阳性菌(+++)、革兰阴性菌(+++),这其实并没有多少意义,但有的科室部分医生一看到几个加号,就开始不得了了,实在让人不敢恭维。如果患者没有得到专业指导,则随便糊弄出一口痰,更多的时候可能只是一坨口水,而口腔和口咽部的正常菌群是非常多的,而且致病力很低,比如草绿色链球菌、肠球菌等,非常常见,而致病力极其低微,这样的结果其实是没有实际用途的。
那有没有办法不让口咽部的正常菌群污染到标本呢?当然有,比如经气管穿刺吸引物、经支气管镜采样等,直接采集下呼吸道标本而不受上呼吸道正常菌群污染,当然结果比痰标本要可信得多,但这都是侵入性的检查,有点杀鸡用牛刀的感觉,除非病情需要,否则不会轻易实施。再说,价格也相差十万八千里,不可能天天都做啊。
痰涂片、痰培养需一起开医嘱
由于人体喉以上呼吸道黏膜表面及其分泌物含有众多微生物,唾液含菌量非常多,老年、重症或住院病人的上呼吸道定植致病菌更多,致使途径口咽部的咳痰经常受到污染,影响结果判定。痰标本的优劣,或者是否能避开上呼吸道菌群污染而采集下呼吸道感染部位的标本,直接影响病原学诊断的准确性和可靠性。再次强调,由于咳痰非常容易受到口咽部定植菌污染,分离到的细菌往往不能真正代表下呼吸道感染的病原菌,为减少污染,痰培养前需要做标本质量评估,即细胞学筛选,虽然部分痰标本通过肉眼观察其外观如黏液和脓性成分,可大致了解受检标本的质量,但仅凭此点尚不足,痰涂片细胞学检查判断标本受污染程度则是一种较为可靠的方法。对于要求细菌培养的痰标本都要常规涂片革兰染色,明确唾液对标本的污染程度和有无必要做细菌培养。
而非呼吸科的其他科室,很少会开“痰涂片”这样的医嘱,都是直接开“痰培养”,认为这是省事。这当然是不正确的,痰涂片很重要,可以简单认为它是“开路人”,“排头兵”等,过了它这关,下面的培养才有意义。笔者也联系过检验科的同事,有人认为,即使医生不开“痰涂片”的医嘱,检验科的同事也会涂片染色检查。但是不是所有地方所有人都这样,笔者就不敢说了。
一般认为,来自下呼吸道的合格痰标本应是含有脓细胞和支气管柱状上皮细胞较多,而受到唾液污染严重的不合格的标本则来自颊黏膜的扁平鳞状上皮细胞较多,镜检筛选制度(痰涂片),剔除代表上呼吸道污染的标本,这是非常有益的。下图介绍的是我国的合格的痰标本的标准的规定。
总的来说,痰涂片、痰标本对临床是意义的,尤其是痰涂片看到抗酸杆菌的时候,但痰液标本的质量控制,才是更为关键的。否则,痰培养的结果可能会误导临床。
来源:搜狐健康网
留取痰培养标本危险因素分析
默认分类 • dearhang 发表了文章 • 0 个评论 • 457 次浏览 • 2017-01-03 11:49
呼吸科的住院病人,几乎没有例外,都要做这样一个检查:痰涂片(找细菌、真菌、抗酸杆菌)或痰培养+药敏。痰标本可用于普通细菌、分支杆菌、真菌和军团菌的检测,但不适用于检测厌氧菌。因为引起下呼吸道感染的厌氧菌多为条件致病菌,而口咽内有大量厌氧菌定植,所以采集彻底避免上呼吸道菌群污染的标本才是准确建立厌氧菌感染病原学诊断的关键。而日常的咳痰、经口咽部支气管镜下呼吸道吸引物甚至是普通支气管肺泡灌洗液,均不能用于厌氧菌检验。目前推崇的主要为防污染采样毛刷(PSB)、经皮肤针刺吸引物(TNA)。
我们要求:
1、使用抗生素前采集标本,若患者有假牙,应摘掉牙托,清洁口腔(刷牙或漱口),咳出深部痰液;
2、留痰时,应在医护人员直视下采集;
3、痰标本采集后1-2h内必须送检,因为室温下2h会降低肺炎链球菌、流感嗜血杆菌等苛养菌的分离率,而定植于上呼吸道的非致病菌以及许多条件致病菌可过度生长;
4、尽可能每天送检一次痰标本,连续3天。
目前,我院病原学诊断阳性率较低,临床医生没有针对性地使用敏感抗菌药物,大多数情况都是经验用药。分析原因:
1、医护人员为告知病人如何正确留痰;
2、病人往往将口水当作痰液吐在标本盒内;
3、经常是将痰盒交给病人,不管病人什么时候留取痰标本,因此,常出现患者晚上留痰,第二天早上才送标本的情况;
4、病人经常晚上入院,入院后即刻使用抗生素,第二天早上留痰标本;
5、有时医生只开一个医嘱,因此,只留取一次痰培养+药敏。
痰标本采集本身是很简单,但要真正做到正确的就比较少了。由于人体喉以上呼吸道黏膜表面及其分泌物含有众多微生物,唾液含菌量非常多,老年、重症或住院病人的上呼吸道定植致病菌更多,致使途径口咽部的咳痰经常受到污染,严重影响医生的诊断和抗生素的选用。根据痰培养结果,结合临床表现、影像学改变等因素可综合评估患者的病情、正确指导治疗。涂片、痰培养需一起开
整改措施:为减少污染,痰培养前需要做标本质量评估,即细胞学筛选,虽然部分痰标本通过肉眼观察其外观如黏液和脓性成分,可大致了解受检标本的质量,但仅凭此点尚不足,痰涂片细胞学检查判断标本受污染程度则是一种较为可靠的方法。对于要求细菌培养的痰标本都要常规涂片革兰染色,明确唾液对标本的污染程度和有无必要做细菌培养。
一般认为,来自下呼吸道的合格痰标本应是含有脓细胞和支气管柱状上皮细胞较多,而受到唾液污染严重的不合格的标本则来自颊黏膜的扁平鳞状上皮细胞较多,镜检筛选制度(痰涂片),剔除代表上呼吸道污染的标本,这是非常有益的。
总之,正确的留取痰标本意义重大,必须认识存在的不利因素并积极、主动及努力克服这些因素,送合格的标本,得到正确的结果,保证临床医生准确的判断。 查看全部
我们要求:
1、使用抗生素前采集标本,若患者有假牙,应摘掉牙托,清洁口腔(刷牙或漱口),咳出深部痰液;
2、留痰时,应在医护人员直视下采集;
3、痰标本采集后1-2h内必须送检,因为室温下2h会降低肺炎链球菌、流感嗜血杆菌等苛养菌的分离率,而定植于上呼吸道的非致病菌以及许多条件致病菌可过度生长;
4、尽可能每天送检一次痰标本,连续3天。
目前,我院病原学诊断阳性率较低,临床医生没有针对性地使用敏感抗菌药物,大多数情况都是经验用药。分析原因:
1、医护人员为告知病人如何正确留痰;
2、病人往往将口水当作痰液吐在标本盒内;
3、经常是将痰盒交给病人,不管病人什么时候留取痰标本,因此,常出现患者晚上留痰,第二天早上才送标本的情况;
4、病人经常晚上入院,入院后即刻使用抗生素,第二天早上留痰标本;
5、有时医生只开一个医嘱,因此,只留取一次痰培养+药敏。
痰标本采集本身是很简单,但要真正做到正确的就比较少了。由于人体喉以上呼吸道黏膜表面及其分泌物含有众多微生物,唾液含菌量非常多,老年、重症或住院病人的上呼吸道定植致病菌更多,致使途径口咽部的咳痰经常受到污染,严重影响医生的诊断和抗生素的选用。根据痰培养结果,结合临床表现、影像学改变等因素可综合评估患者的病情、正确指导治疗。涂片、痰培养需一起开
整改措施:为减少污染,痰培养前需要做标本质量评估,即细胞学筛选,虽然部分痰标本通过肉眼观察其外观如黏液和脓性成分,可大致了解受检标本的质量,但仅凭此点尚不足,痰涂片细胞学检查判断标本受污染程度则是一种较为可靠的方法。对于要求细菌培养的痰标本都要常规涂片革兰染色,明确唾液对标本的污染程度和有无必要做细菌培养。
一般认为,来自下呼吸道的合格痰标本应是含有脓细胞和支气管柱状上皮细胞较多,而受到唾液污染严重的不合格的标本则来自颊黏膜的扁平鳞状上皮细胞较多,镜检筛选制度(痰涂片),剔除代表上呼吸道污染的标本,这是非常有益的。
总之,正确的留取痰标本意义重大,必须认识存在的不利因素并积极、主动及努力克服这些因素,送合格的标本,得到正确的结果,保证临床医生准确的判断。 查看全部
呼吸科的住院病人,几乎没有例外,都要做这样一个检查:痰涂片(找细菌、真菌、抗酸杆菌)或痰培养+药敏。痰标本可用于普通细菌、分支杆菌、真菌和军团菌的检测,但不适用于检测厌氧菌。因为引起下呼吸道感染的厌氧菌多为条件致病菌,而口咽内有大量厌氧菌定植,所以采集彻底避免上呼吸道菌群污染的标本才是准确建立厌氧菌感染病原学诊断的关键。而日常的咳痰、经口咽部支气管镜下呼吸道吸引物甚至是普通支气管肺泡灌洗液,均不能用于厌氧菌检验。目前推崇的主要为防污染采样毛刷(PSB)、经皮肤针刺吸引物(TNA)。
我们要求:
1、使用抗生素前采集标本,若患者有假牙,应摘掉牙托,清洁口腔(刷牙或漱口),咳出深部痰液;
2、留痰时,应在医护人员直视下采集;
3、痰标本采集后1-2h内必须送检,因为室温下2h会降低肺炎链球菌、流感嗜血杆菌等苛养菌的分离率,而定植于上呼吸道的非致病菌以及许多条件致病菌可过度生长;
4、尽可能每天送检一次痰标本,连续3天。
目前,我院病原学诊断阳性率较低,临床医生没有针对性地使用敏感抗菌药物,大多数情况都是经验用药。分析原因:
1、医护人员为告知病人如何正确留痰;
2、病人往往将口水当作痰液吐在标本盒内;
3、经常是将痰盒交给病人,不管病人什么时候留取痰标本,因此,常出现患者晚上留痰,第二天早上才送标本的情况;
4、病人经常晚上入院,入院后即刻使用抗生素,第二天早上留痰标本;
5、有时医生只开一个医嘱,因此,只留取一次痰培养+药敏。
痰标本采集本身是很简单,但要真正做到正确的就比较少了。由于人体喉以上呼吸道黏膜表面及其分泌物含有众多微生物,唾液含菌量非常多,老年、重症或住院病人的上呼吸道定植致病菌更多,致使途径口咽部的咳痰经常受到污染,严重影响医生的诊断和抗生素的选用。根据痰培养结果,结合临床表现、影像学改变等因素可综合评估患者的病情、正确指导治疗。涂片、痰培养需一起开
整改措施:为减少污染,痰培养前需要做标本质量评估,即细胞学筛选,虽然部分痰标本通过肉眼观察其外观如黏液和脓性成分,可大致了解受检标本的质量,但仅凭此点尚不足,痰涂片细胞学检查判断标本受污染程度则是一种较为可靠的方法。对于要求细菌培养的痰标本都要常规涂片革兰染色,明确唾液对标本的污染程度和有无必要做细菌培养。
一般认为,来自下呼吸道的合格痰标本应是含有脓细胞和支气管柱状上皮细胞较多,而受到唾液污染严重的不合格的标本则来自颊黏膜的扁平鳞状上皮细胞较多,镜检筛选制度(痰涂片),剔除代表上呼吸道污染的标本,这是非常有益的。
总之,正确的留取痰标本意义重大,必须认识存在的不利因素并积极、主动及努力克服这些因素,送合格的标本,得到正确的结果,保证临床医生准确的判断。